维多利亚州遵守最高等级的国际临床试验标准。
单一伦理审查——在良好治理框架内节省您的时间。
维多利亚州遵守澳大利亚联邦政府实行的《全国单一伦理审查方案》,即由单一人类研究伦理委员会(HREC)对研究计划实行多中心研究项目的伦理审查,审查得到其他参与机构的认可。这就能给您的临床试验带来如下好处:
- 效率——所有行政体系均实行统一的程序和规程办理时限。
- 信赖——对多中心研究计划实行的单一伦理审查,受其他机构认可,无需由机构内部的HREC再次审查。
- 尊重——全国方案充分兼顾了行政辖区监管和行政框架以及机构部署的差异。
- 合规——多中心人类研究项目的单一伦理审查,符合全国声明关于保护人类研究参与者的要求。
全国卫生与医学研究委员会(NHMRC)已认证批准了45家机构共计49个HREC的伦理审查程序。这其中很多机构凭借自身的技术专长,已获认证可以评估临床试验申请。
维多利亚州如何对临床试验进行监管?
澳大利亚的临床试验工作,根据联邦、州和领地立法规定,实行多级监管体系。联邦卫生部下属部门TGA,采取类似美国联邦药品管理局(FDA)的方式,负责监管药品和医疗设备.
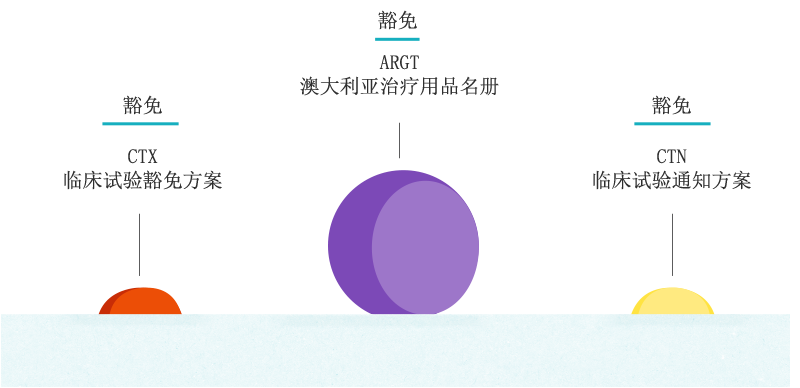
TGA监管药品和医疗设备列入澳大利亚治疗用品名册(ARTG)的情况。一般来说,除非获得豁免,否则澳大利亚进口或生产、由公司提供、跨州提供或供应给联邦政府或出口的人体使用的药品或医疗设备,必须列入ARTG。供应用于临床试验的未获批准的药品和医疗设备,需依据《临床试验通知方案》(CTN)或通过《临床试验豁免方案》(CTX)申请豁免。
澳大利亚治疗用品管理局(TGA)负责监管药品和医疗设备。
除豁免情况外,TGA将负责监管您所有在澳洲治疗用品名册上的药品设备
如何最大限度消除监管负担?
澳大利亚贸易委员会(澳贸委)报告显示,二十多年来,澳大利亚临床试验通知方案在减轻临床试验申报方监管负担方面,已成为全球最佳实践标杆。CTN方案消除了不必要的重复工作,帮助在澳大利亚实施临床试验的申办方节省大量时间和金钱。
大多数澳大利亚商业型临床试验均依据CTN方案来实施。包括临床试验方案在内拟议临床试验的所有相关材料,由研究人员根据相关申报方的要求,直接提交给机构伦理委员会。伦理委员会专门负责评估临床试验设计的科学有效性、药品或设备的安全性和功效、试验过程的伦理合规性,并负责审批试验方案。
临床试验拟实施所在机构,负责最终审批在自身场所实施临床试验。根据CTN方案的规定,临床试验项目只需在取得场所审批后通知TGA,TGA无需审查任何相关数据。TGA无权审查和过问临床试验项目的管理情况。
阅读本文的人士也有兴趣阅读:
> 有什么吸引人的税收奖励措施,哪些人符合条件?
> 如何保护宝贵的知识产权?


